L’ammoniac est l’un des produits les moins documenté en Français pour les aquariophiles. On trouve ainsi presque rien sur les détails de son absorption, de son excrétion et de ses mécanismes de toxicité, et tout un tas de choses. Tous ces sujets dans un même temps continuent d’occuper de nombreux chercheurs pour arriver à décortiquer les mécanismes en jeu.
Ce test ne fait pas partie des routines de paramètres à surveiller de près mais de temps à autre cela peut s’avérer utile.
Attention aux faux amis
Dans cet article, j’ai commencé par douter sur l’orthographe, Ammoniac ou Ammoniaque ? Il ne faut pas confondre l’ammoniac (NH3) avec l’ammoniaque (NH4OH) dont l’écriture est différente. L’ammoniaque est en fait de l’hydroxyde d’ammonium (NH4OH) c’est la solution aqueuse d’ammoniac. Comme en plus j’ai utilisé des sources en langue étrangère, j’ai fait le choix d’écrire Ammoniac.
Résumé
L’ammoniac est très toxique pour les poissons marins et d’autres organismes dans un aquarium récifal. Bien que la mesure régulière de l’ammoniac ne soit pas habituellement requise dans les aquariums récifaux établis, elle peut être très importante lorsque les poissons se trouvent dans des locaux temporaires, tels que les sacs d’expédition, les bacs hôpitaux et les bacs de quarantaine. La plupart des aquariophiles associent l’ammoniac à un nouveau «cycle» d’aquarium et, dans cette situation, il est extrêmement important d’attendre que l’ammoniac diminue avant d’ajouter des organismes (ce qui est beaucoup plus important que d’attendre que le nitrite diminue).
L’ammoniac peut également être très important pendant les crashs. Dans toutes ces situations, je recommande de s’efforcer de maintenir l’ammoniac en dessous de 0,1 ppm de NH4-N total. Si le niveau s’élève au-dessus de 0,25 ppm de NH 4 -N total, je suggère de prendre des mesures immédiates, telles que l’utilisation d’un liant ammoniacal ou des changements d’eau.
Ammoniac : Poison caché
En raison de sa toxicité élevée, il est extrêmement important dans les aquariums marins de limiter sa présence. En fait, c’est l’un des rares problèmes chimiques importants que partagent les aquariums marins et d’eau douce. Néanmoins, les malentendus abondent sur les sources, la nature et la toxicité de l’ammoniac, qui peuvent ne pas être reconnues par de nombreux aquariophiles
Tout va bien en général
Ordinairement, les aquariums récifaux établis n’ont pas de problèmes avec l’ammoniac parce que leurs grandes quantités de bactéries et d’algues servent à l’éliminer rapidement de l’eau. Cependant, de nouveaux aquariums, des bacs hôpitaux, les quarantaines, les sacs d’expédition et des aquariums récifaux contenant quelque chose qui est mort peuvent avoir des niveaux d’ammoniac qui atteignent rapidement des niveaux toxiques. En fait, je crois que, avec un faible taux d’oxygène (hypoxie due par exemple a une explosion bactérienne), l’ammoniac peut être la principale cause immédiate de nombreux crashs et perte de population.
Mécanisme du crash a l’ammoniac
Quelque chose meurt, il se désintègre et libère de l’ammoniac, l’ammoniac tue quelque chose d’autre et le système échappe à tout contrôle, l’ammoniac étant le facteur principal.
Comprendre
Cet article tente de fournir une base détaillée pour comprendre l’ammoniac dans l’eau de mer – d’où il vient, comment il devient toxique et à quelles concentrations, comment faire face aux urgences liées à l’ammoniac.
Les sections sont:
Introduction
L’ammoniac (NH3 ) peut exister sous deux formes primaires dans l’eau. L’un est de l’ammoniac libre et le second est un ion ammonium (NH4+). Un ion ammonium est formé lorsqu’un proton en solution se combine avec de l’ammoniac:
NH3 + H+ => NH4+
L’eau contient toujours des protons, et plus le pH de l’eau est bas, plus il y a de protons. En fait, une baisse d’une unité de pH signifie exactement une multiplication par dix du nombre de protons. Donc, à un pH plus bas, où il y a une grande quantité de H+ , l’équilibre s’éloigne de l’ammoniac et de l’ammonium. Ce changement est en fait très important pour comprendre sa toxicité, car NH3 et NH4+ peuvent avoir des taux de passage différents à travers les branchies des poissons.
Cet échange entre l’ammoniac et l’ammonium est incroyablement rapide. Cela peut se produire en un milliardième de seconde, et pour une seule molécule d’ammoniac, la conversion peut se produire un milliard de fois par seconde. Il est donc souvent inapproprié, à l’échelle du temps humain, de les considérer comme des éléments différents, mais plutôt de penser qu’une molécule d’ammoniac individuelle passe une partie de son temps sous forme d’ammoniac libre, et une partie de son temps comme ion ammonium, avec ces parties de temps relatives étant une fonction du pH.
L’ammoniac et l’ammonium en fonction du pH
Le pKa de l’ammonium dans l’eau de mer est d’environ 9,3 (certaines références indiquent l’état 9.5, la différence pouvant être liée aux différentes échelles de pH parfois utilisées pour l’eau de mer et l’eau douce). Ce pKa signifie qu’à pH 9,3, l’eau a des concentrations égales d’ammonium et d’ammoniac. À des valeurs de pH inférieures à ce niveau, comme c’est toujours le cas dans les aquariums récifaux, l’ammonium prédomine. La figure 1 montre un graphique des fractions relatives de l’ammoniac et de l’ammonium en fonction du pH dans l’eau de mer. A pH 8,2, seulement environ 7% de l’ammoniac est présent sous forme d’ammoniac libre, avec 93% présent sous forme d’ammonium.
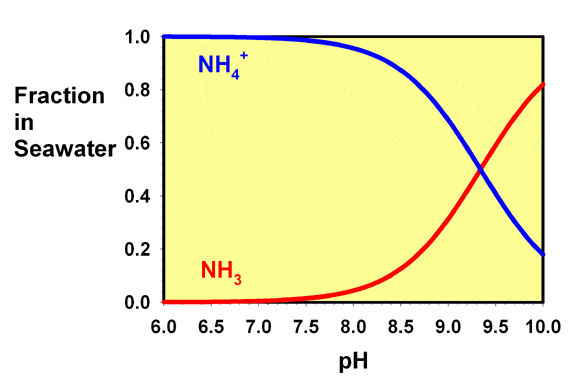
La figure 1 montre un graphique des fractions relatives de l’ammoniac et de l’ammonium en fonction du pH dans l’eau de mer. A un pH de 8.2 , seulement environ 7% de l’ammoniac est présent sous forme d’ammoniac libre, avec 93% présent sous forme d’ammonium.
Comme de nombreux auteurs attribuent la toxicité de l’ammoniac principalement à l’ammoniac libre (que ce soit correct ou non, voir ci-dessous), la figure 2 montre une vue agrandie de la concentration d’ammoniac libre dans les aquariums récifaux. La quantité d’ammoniac libre présente à pH 7,8 est environ le quart de la quantité présente à pH 8,5.
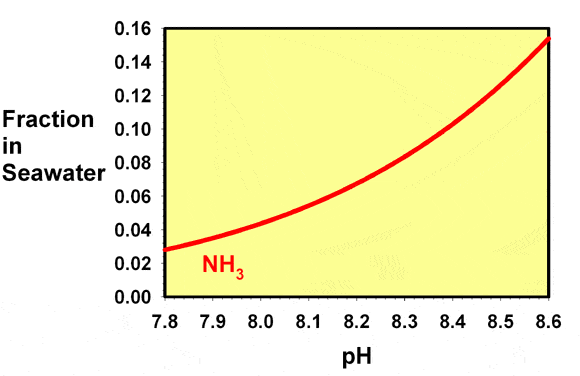
Les aquariophiles récifaux peuvent aussi être confrontés à des valeurs de pH inférieures à celles généralement présentes dans les aquariums récifaux. Un sac d’expédition contenant du poisson, par exemple, chute souvent sensiblement au niveau du pH en fonction du temps de transport. Au cours du trajet durant quelques des heures ou des jours, à cause du dioxyde de carbone expulsé par respiration. Ce changement de pH peut convertir encore plus d’ammoniac libre en ammonium, et la figure 3 montre les fractions d’ammoniac et d’ammonium sur une échelle logarithmique, indiquant clairement que l’ammoniac libre continue de baisser à mesure que le pH baisse, même quand il est déjà présent comme une très petite fraction.
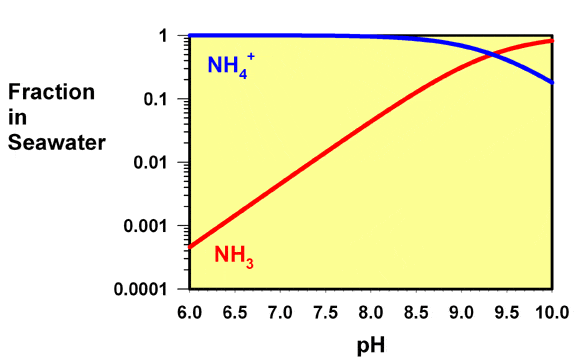
Unités de mesure de l’ammoniac et de l’ammonium
Une variété d’unités différentes ont été utilisées pour signaler les concentrations d’ammoniac. Une première unité “ppm NH3-N” représente les parties par million d’azote dans l’ammoniac libre de l’échantillon. L’unité “ppm NH4+ -N” représente les parties par million d’azote dans l’ammonium de l’échantillon. Enfin l’unité «ppm NH4-N total» est souvent utilisée pour représenter la somme de l’azote dans l’ammoniac et l’ammonium dans l’échantillon.
Concentration d’ammoniac dans l’océan
La concentration d’ammoniac dans l’océan varie considérablement, passant de moins de 0,002 ppm à 0,7 ppm de NH4-N total, mais elle est généralement très faible dans l’eau de mer superficielle (<0,02 ppm de NH4-N total). Par exemple, l’apport d’eau de mer à l’Institut de biologie marine d’Hawaï (sur l’île Coconut, Oahu, HI, 150 pieds de la côte et 20 pieds vers le bas) a un niveau d’ammoniac supérieur à 0,0025 ± 0,0021 ppm NH4-N. Les eaux de surface océaniques distantes ont une teneur totale en NH4-N de 0,006 ± 0,004 ppm.
Sources d’ammoniac dans les aquariums récifaux : mélanges de sel
Il y a une variété de sources d’ammoniac pour les aquariums récifaux. Les sources mineures comprennent:
l’eau (surtout si elle contient de la chloramine et n’est pas traitée avec une résine désionisante )
- les impuretés dans les mélanges de sel et autres additifs.
- Il a déjà été montré que le NH4-N total variait de 0,55 à 11,9 micromoles / kg (0,008 à 0,17 ppm de NH4-N total) dans une analyse de huit marques de mélanges de sel pour créer de l’eau de mer artificielle.
- Cet ammoniac peut être introduits à partir d’impuretés dans le chlorure de calcium et le chlorure de magnésium, où l’ammoniac est une impureté bien connue résultant de certains des procédés de fabrication commerciaux utilisés (tels que le procédé Solvay qui implique l’ammoniac).
Sources d’ammoniac dans les aquariums récifaux: processus biologiques
La source prédominante d’ammoniac dans les aquariums marins est l’excrétion par les poissons et autres animaux hétérotrophes (organismes vivant en consommant des matières organiques). Les poissons excrètent de grandes quantités d’ammoniac (et d’ammonium) dans leurs branchies et possiblement de plus petites quantités dans leur urine, ce qui explique pourquoi tous les aquariums doivent contenir un mécanisme permettant d’empêcher l’ammoniac excrété d’atteindre des niveaux toxiques. Les bactéries hétérotrophes peuvent également être une grande source d’ammoniac dans les aquariums. Une nourriture pour poisson non consommée qui est décomposée par une action bactérienne entraîne habituellement la libération d’ammoniac dans l’eau. De nombreux autres organismes marins que l’on trouve dans les aquariums récifaux excrètent également de l’ammoniac, comme les crabes et les crevettes. En fait, la plupart des organismes vivants d’un aquarium récifal en consommant de la nourriture (plutôt que par photosynthèse) excrètent une certaine quantité d’ammoniac.
La raison pour laquelle ces organismes excrètent de l’ammoniac est qu’ils absorbent beaucoup plus d’azote des aliments qu’ils n’en consomment pour construire de nouveaux tissus. Par conséquent, ils doivent excréter l’azote d’une certaine manière. L’ammoniac est un moyen courant d’excréter l’azote, ainsi que l’urée et quelques autres composés azotés. L’équation chimique ci-dessous représente les produits finaux résultant du métabolisme des composés organiques avec une formule moléculaire représentant le plancton typique dans l’eau de mer:
(CH2O) 106 (NH3) 16 (H3 PO4) + 106 O2 à 106 CO2 + 106 H2O + 3 H+ + PO4— + 16 NH3
Mécanismes de l’excrétion d’ammoniac par les poissons marins
Les mécanismes par lesquels les poissons marins excrètent de l’ammoniac diffèrent de ceux des poissons d’eau douce, et les aquariophiles doivent veiller à ne pas extrapoler les résultats des poissons d’eau douce aux espèces marines.
Les branchies
Les poissons marins excrètent de l’ammoniac par leurs branchies de plusieurs façons. Comme chez les poissons d’eau douce, l’ammoniac libre peut être diffusé passivement hors des cellules qui constituent les branchies, et c’est souvent la voie dominante de l’excrétion. Ce fait a de grandes implications pour la toxicité de l’ammoniac pour les poissons. Parce que l’ammoniac libre est diffusé passivement hors des cellules et dans l’eau de mer environnante. Il faut donc une différence de concentration entre ce que le poisson souhaite évacuer et la concentration en eau de mer. Si la concentration d’ammoniac dans l’eau de mer augmente, ce mécanisme excréteur ne fonctionne pas efficacement. Il pourrait même fonctionner à l’envers. Parce que c’est la concentration d’ammoniac libre dans le fluide environnant qui détermine la capacité de l’ammoniac libre à être excrété de cette manière, le pH joue un rôle important dans la détermination de la capacité de l’ammoniac à empêcher ce mécanisme excréteur de fonctionner. Un pH plus bas dans l’eau de mer environnante convertit une plus grande partie de l’ammoniac en ammonium, laissant moins d’ammoniac libre pour sauvegarder cette voie excrétoire, ce qui réduit la toxicité observée.
La peau
Cependant, la notion scientifique selon laquelle la voie de diffusion implique une simple diffusion de l’ammoniac libre à travers les membranes cellulaires ne semble plus être soutenue par des études récentes utilisant des techniques biomoléculaires modernes. Il est maintenant reconnu que cette diffusion passive de NH3 se produit plus probablement à travers les espaces entre les cellules, appelées jonctions serrées paracellulaires, et ce phénomène de transfert est appelé transport paracellulaire. Ces jonctions, bien que généralement suffisamment serrées pour empêcher les grosses molécules de passer, présentent une interstice suffisante, tant chez les poissons marins que dans les poissons d’eau douce, pour permettre le passage de l’eau et de l’ammoniac.
Différence eau douce / eau de mer
Sans entrer dans les détails sur la différence entre l’eau douce et marines pour l’excrétion d’ammoniac (il existe d’autres différences importantes), une différence très importante est que les jonctions paracellulaires chez les poissons marins sont plus perméables que chez les poissons d’eau douce. Les poissons marins peuvent excréter passivement une quantité nettement supérieure d’ion ammonium. Comme cette voie implique également la diffusion passive de l’ammonium du sang vers le liquide environnant, la conversion de l’ammoniac en ammonium dans l’environnement ambiant à faible pH ne peut réduire complètement la toxicité de l’ammoniac / ammonium dans le liquide environnant, même si elle peut largement le faire pour les poissons d’eau douce.
Cas particuliers pour les poissons utilisant les branchies
Il existe également d’autres mécanismes par lesquels l’ammoniac peut être excrété par les branchies du poisson. Ceux-ci comprennent une protéine anti-porteuse dans les membranes des cellules branchiales qui permet au sodium d’entrer, et utilise l’énergie chimique de ce processus pour pomper l’ion ammonium. Ce procédé peut ne pas être utilisé dans des conditions normales, où la diffusion passive de l’ammoniac et de l’ammonium prédomine, mais peut être très importante lorsque les concentrations d’ammoniac et d’ammonium augmentent excessivement (> 1 ppm NH3-N ), le laissant comme seul mécanisme viable pour l’excrétion d’ammoniac. Comme certains poissons se sont adaptés et survivent dans de tels environnements (certains poissons vivant dans les terriers, par exemple), ce mécanisme peut leur être critique.
Réduction de l’ammoniac dans l’aquarium récifal: Nitrification bactérienne
La plupart des aquariophiles marins sont conscients du «cycle de l’azote» qui commence lorsque l’ammoniac dans l’eau est oxydé en nitrite par les bactéries. Ce nitrite est ensuite oxydé par différentes bactéries en nitrate :
NH4+ + 3/2 O2 => NO2- + 2H+ + H2O
NO2- + ½ O2 => NO3-
De nombreuses études ont porté sur la conversion de l’ammoniac en nitrite, et de nombreux articles ont été écrits pour les aquariophiles professionnels et amateurs en anglais qui détaillent divers aspects pratiques du processus, tels que la mise en place de filtres appropriés pour faciliter ce processus. Beaucoup d’aquariums récifaux n’ont pas de filtres spécialement conçus à cet effet, et les bactéries qui procèdent à ce processus résident dans les décors et la plupart des surfaces de l’aquarium, y compris les roches, le sable, le verre et même les surfaces d’autres organismes (algues coralines, …).
Importance de la surface colonisable
Une chose importante à retenir, cependant, est que la plupart de ces bactéries résident sur des surfaces. Il faut donc concevoir l’aquarium pour qu’il ait suffisamment de bactéries pour fournir la nitrification. Cette information est importante lorsque vous déplacez apportez des organismes dans un nouvel aquarium. Apporter de l’eau depuis un aquarium existant peut aider à démarrer une culture de bactéries, mais ne fournira pas beaucoup de capacité de nitrification. Cependant, l’apport de roches et de sable et d’une petite quantité d’eau peut être très efficace pour fournir instantanément une capacité de nitrification adéquate.
Quelles bactéries entrent en action
Le processus de nitrification est rarement aussi simple que le croient de nombreux aquariophiles. Ce n’est pas toujours une seule espèce de bactérie qui effectue le processus, par exemple. Dans l’océan, de nombreuses espèces de bactéries peuvent oxyder l’ammoniac, y compris Nitrosospiras , Nitrosomonas et Nitrosococcus. Lorsqu’elles sont étudiées dans des aquariums d’eau douce (où davantage de recherches ont été effectuées que dans les aquariums marins), les bactéries sont souvent représentées par une variété d’espèces et de souches différentes, et ne sont pas toujours dominées par un type. Dans les aquariums marins, cette variétée peut comprendre Nitrosomonas marina et Nitrosomonas europaea. Bien qu’il soit peu important pour la plupart des aquariophiles de savoir quelles espèces de bactéries transforment l’ammoniac en nitrites.
Un grand vide d’informations
Dans le même ordre d’idées, j’ai vu peu d’études, voire aucune, sur la pertinence de l’un quelconque des divers produits commerciaux prévus pour booster les bactéries. Il est certainement possible pour les cultures vivantes d’accélérer l’accumulation de niveaux appropriés de bactéries nitrifiantes pour contrôler l’ammoniac. Des cultures correctement ajoutées peuvent presque immédiatement commencer à traiter l’ammoniac. Les cultures choisies doivent cependant avoir été élevées dans des conditions de température, de nutriments et de salinité similaires à celles de l’aquarium auquel elles sont ajoutées pour que cette efficacité soit optimale, et je ne sais pas si des cultures bactériennes commerciales vendues à des amateurs cette exigence. J’ai même pour être franc de plus en plus de doutes.
Élimination de l’ammoniac dans l’aquarium récifal : Les Algues
De nombreux organismes absorbent directement l’ammoniac pour fabriquer les protéines et autres biomolécules dont ils ont besoin pour fabriquer des tissus. Les algues, à la fois micro et macro, utilisent facilement l’ammoniac de l’eau. Dans les cas où ils sont exposés à la fois au nitrate et à l’ammoniac comme sources d’azote, beaucoup préfèrent absorber l’ammoniac. Lorsqu’on utilise du nitrate, de nombreuses voies biochimiques pertinentes exigent de l’organisme qu’il réduise le nitrate en ammoniac avant de l’utiliser. Il est donc logique d’absorber l’ammoniac. Il n’a pas été établi dans un aquarium cependant, quelle partie de l’absorption d’azote et d’ammoniac absorbent les macro algues et quelle fraction de nitrate.
Combien peut retirer un filtre a algue ?
La quantité d’azote absorbée par un filtre algal est importante. Des études ont été menées pour mesurer les capacités d’exportation potentielles des algues. Elles donne la teneur en phosphore et en azote de neuf espèces différentes de macroalgues, dont beaucoup sont maintenues par les récifalistes. Par exemple, Caulerpa racemosa récolté au large d’Hawaii contient environ 0,08% en poids sec de phosphore et 5,6% d’azote. Pour un échantillon de 454 g (poids sec) de cette macro-algue à partir d’un aquarium récifal équivaudrait à enlever 25,4 grammes d’azote qui, si tous étaient présents dans un aquarium de 500 litres sous forme d’ammoniac, équivaudraient à une concentration de 67 ppm de NH4-N total. Même s’il fallait trois mois pour atteindre cette masse, l’équivalent de 0,75 ppm de NH4-N par jour serait effectivement éliminé.
Test de l’ammoniac
Il y a plusieurs façons de tester l’ammoniac dans l’eau de mer. Ceux-ci comprennent des kits de test basés à la fois sur le salicylate et la chimie de Nessler.
Kits de test Nessler
La réaction de l’ammoniac avec le réactif de Nessler , K2 HgI4 , forme un précipité coloré de (Hg2 N) I · H2O. De faibles niveaux d’ammoniac sont jaunes, plus élevés sont orange et même des niveaux plus élevés peuvent être bruns. La réaction globale est:
NH3 + 2 [HgI4]2- + 3OH – → HgO · Hg (NH2)I + 7I – + 2H2O
Une préoccupation importante avec la méthode de Nessler est la toxicité et la nature dangereuse des déchets générés par son utilisation (elle contient du mercure).
Kits de test de salicylate
La réaction de l’ammoniac avec l’hypochlorite forme de la monochloramine, qui réagit ensuite avec le salicylate en présence de nitro-ferricyanure de sodium pour former le 5-aminosalicylate. Ce complexe est jaune à vert à vert foncé en fonction du niveau d’ammoniac présent.
De faux positifs connus
La distinction entre ces méthodes peut être importante, car certaines combinaisons de produits de liaison à l’ammoniac et de méthodes d’essai peuvent conduire à de faux résultats d’ammoniac (soit une présence apparente d’ammoniac lorsqu’elle est liée, soit une couleur non prédite par le kit de test ). Par exemple, une trousse de type Nessler ne peut pas lire correctement l’ammoniac si l’aquariophile utilise Amquel, Seachem Prime ou des produits connexes pour lier l’ammoniac. Le résultat est souvent une couleur brune hors échelle.
Ainsi, il est particulièrement important que les aquariophiles comprennent comment fonctionne le kit de test qu’ils utilisent, les fabricants de chacun des tests sont le meilleur endroit pour trouver cette information.
Toxicité de l’ammoniac
L’ammoniac est très toxique pour les poissons marins. Les mécanismes de toxicité sont compliqués et constituent un domaine actif d’investigation continue par les chercheurs. Ses effets comprennent des dommages aux branchies, ce qui entraîne un mauvais échange de gaz, la régulation des ions et la régulation du pH sanguin. D’autres effets comprennent l’empêchement de l’apport d’oxygène aux tissus, perturbant le métabolisme et la toxicité pour le système nerveux qui provoque l’hyperactivité, les convulsions et la mort. L’ammoniac peut également être très toxique pour de nombreux autres organismes présents dans les aquariums récifaux.
Données de toxicité
La toxicité peut être mesurée et signalée de plusieurs façons. Une façon courante de mesurer la toxicité aiguë consiste à mesurer le niveau de concentration nécessaire pour tuer la moitié des organismes au cours d’une période donnée. Une période couramment utilisée est de 96 heures (quatre jours). De telles données sont appelées la CL 50 de 96 h (LC signifie concentration létale, 50 signifiant 50% tué).
Influence du pH dans la toxicité
L’autre complication liée à la toxicité de l’ammoniac est la quantité relative d’ammoniac libre et d’ions ammonium. Alors que l’ion ammonium peut être toxique pour les poissons marins, il est probablement moins toxique que l’ammoniac libre, et les données de toxicité sont souvent rapportées uniquement pour la concentration d’ammoniac libre. Les aquariophiles doivent toutefois savoir que de telles données peuvent ne pas être appropriées si le pH utilisé dans l’essai ou la situation à laquelle il s’applique. Les test diffèrent en général significativement du pH normal de l’eau de mer (par exemple, dans un sac d’expédition dont le pH peut être bien inférieur à pH 8,2 et dont la toxicité peut en réalité provenir de l’ammonium, et non de la faible concentration d’ammoniac libre). Néanmoins, de nombreux articles scientifiques rapportent la toxicité de l’ammoniac en ppm (ou mg / L) de NH3-N . Il peut également être rapporté en ppm NH3 seulement.
Comme vu dans l’article sur gérer son pH :
Il existe une relation entre les niveaux d’ammoniac et le pH. Si vous êtes sceptique quant à l’importance de maintenir un pH stable dans votre aquarium, prenez le temps de lire comment l’ammoniaque devient encore plus toxique dans l’aquarium à des niveaux de pH plus élevés. Même la plus petite quantité d’ammoniac (aussi faible que 0,6 ppm) peut être mortelle pour les poissons, mais la toxicité de l’ammoniac devient encore plus dangereuse lorsque les niveaux de pH dépassent 8,5. Reportez-vous au tableau ci-dessous:
|
Température |
pH 7.0 |
pH 7,5 |
pH 8.0 |
pH 8,5 |
|
20 ° C |
0,40 |
1,24 |
4,82 |
11.2 |
|
25 ° C |
0,57 |
1,77 |
5,38 |
15,3 |
|
28 ° C |
0.70 |
2,17 |
6,56 |
18,2 |
|
30 ° C |
0,80 |
2,48 |
7.46 |
20,3 |
Comme vous pouvez le voir, l’ammoniac devient plus concentré et toxique à des niveaux de pH plus élevés. Une augmentation de la température affectera également la toxicité de l’ammoniac dans l’eau du bac.
Quantité d’ammoniac nécessaire a tuer nos poissons
Les poissons marins ont généralement des niveaux de LC 50 de 96 h qui vont d’environ 0,09 à 3,35 ppm de NH3-N . Ce résultat n’est pas particulièrement différent de l’intervalle observé pour les poissons d’eau douce, de 0,068 à 2,0 ppm de NH3-N . Rappelez-vous que ces valeurs sont ppm NH 3 -N , et à pH 8,2, la gamme marine devient 1,3 à 50 ppm de NH 4 -N total car seulement 7% de l’ammoniac total dans l’eau de mer est présent sous forme d’ammoniac libre.
Problèmes a des doses non létales
Les concentrations d’ammoniac qui ne sont pas létales peuvent causer des problèmes importants aux poissons. Le saumon dans l’eau de mer à pH 7,8, par exemple, montre des changements dans les globules blancs et divers produits chimiques du sang, et était plus sujet à la maladie, lorsqu’il est exposé à des concentrations sublétales d’ammoniac. En conséquence, les aquariophiles devraient s’efforcer de maintenir les concentrations d’ammoniac bien au-dessous des niveaux létaux.
Lignes directrices sur la concentration d’ammoniac
Parce que les effets toxiques de l’ammoniac apparaissent à des niveaux significativement inférieurs à ceux qui sont létaux (0,09 à 3,35 ppm NH 3 -N ou 1,3 à 50 ppm NH 4 -N total à pH 8,2), et parce que certains organismes dans un aquarium récifal peuvent être plus sensibles, il est prudent de pécher par excès de prudence en décidant quelles concentrations d’ammoniac autoriser dans un aquarium récifal ou un système connexe.
Quelle valeur est acceptable ?
Ma suggestion est de prendre une sorte de mesure corrective si l’ammoniac total dépasse 0,1 ppm. Cette suggestion est également faite par Stephen Spotte dans son texte faisant autorité, Captive Seawater Fishes. Les valeurs supérieures à 0,25 ppm d’ammoniac total peuvent nécessiter un traitement immédiat, de préférence en éliminant tous les organismes sensibles (sensibles à l’ammoniac) de l’eau contenant l’ammoniac. Certaines des actions possibles à prendre sont détaillées dans les sections suivantes listées ci-dessous.
Traitements pour les pic d’ammoniac
Hydroxyméthanesulfonate
Divers types de composés sont utilisés dans les produits commerciaux pour lier l’ammoniac dans les aquariums marins. L’un est l’hydroxyméthanesulfonate (HOCH2SO3–). Il s’agit d’un liant d’ammoniac connu breveté pour l’usage en aquarium par John F. Kuhns.
La réaction de l’ammoniac avec l’hydroxyméthanesulfonate est mécaniquement complexe, impliquant éventuellement une décomposition en formaldéhyde et une reformation en aminométhanesulfonate produit (voir ci-dessous). Mes sources trouvées pense que la réaction globale simplifiée est:
NH3 + HOCH2SO3– à H2NCH2SO3– + H2O
Ce qui arrive finalement à l’aminométhanesulfonate dans un aquarium marin ou récifal n’est pas bien établi, mais il semble être significativement moins toxique que l’ammoniac, et il est plus que probable qu’il est traité par des bactéries dans d’autres composés.
Remarque: les produits contenant de l’hydroxyméthanesulfonate entravent la capacité de tester l’ammoniac lors de l’utilisation de certains types de test. Vraisemblablement, le H2NCH2SO3 formé est toujours réactif avec les réactifs de Nessler, même s’il ne s’agit pas d’ammoniac.
clinoptilolite
De nouveaux milieux filtrants sont capables de lier l’ammoniac de l’eau de mer. La zéolite clinoptilolite (un aluminosilicate de sodium) est capable de lier l’ammoniac de l’eau douce, mais les ions de sodium dans l’eau de mer déplacent une grande partie de l’ammoniac. En fait, la capacité de liaison à l’ammoniac de la clinoptilolite dans l’eau douce peut être régénérée en la rinçant avec de l’eau salée. Par conséquent, sa capacité à lier l’ammoniac dans l’eau de mer est très faible, voire inexistante, ce qui fait qu’il n’est pas un produit très utile pour les systèmes marins.
Changements de l’eau
Les changements d’eau peuvent être un bon moyen de réduire les niveaux d’ammoniac toxique, en particulier dans un petit système tel qu’une quarantaine ou un bac d’hôpital. L’utilisation efficace de cette méthode exige toutefois que la nouvelle eau salée ne contienne pas d’ammoniac.
En règle générale, l’ammoniac baisse généralement d’environ la même fraction d’eau que celle qui est changée, de sorte qu’un changement d’eau de 30% réduira l’ammoniac de 30%. Cependant, s’il y a une source d’ammoniac dans l’aquarium, il peut rapidement remonter. Une chute de 30% peut ne pas être remarquée avec de nombreux kits de test. Par exemple, il peut être difficile de distinguer 1,2 ppm de 0,84 ppm NH4-N total en utilisant de nombreux kits, alors ne paniquez pas si le niveau d’ammoniac ne semble pas baisser, mais soyez réaliste quant à combien vous attendez qu’il tombe d’un changement d’eau de l’ordre de 10-30%. Dans une «situation d’urgence» à l’ammoniac, des changements d’eau beaucoup plus importants peuvent être appropriés.
Acclimatation d’animaux ayant voyagé longtemps
La respiration d’un poisson ayant voyagé longtemps va faire descendre le pH de l’eau de transport et ce malgré l’ajout d’oxygène dans les sacs. De plus le stress et les excréments du poisson vont faire monter les taux d’ammoniac. Notre chance étant qu’a un pH bas la toxicité est faible.
Où est le souci alors ?
Le risque est qu’a l’ouverture les échanges gazeux associé a un goutte a goutte avec l’eau de l’aquarium vont faire monter le pH et donc le risque de toxicité de l’ammoniac. On peut donc en toute bonne foie causer des séquelles a nos poissons en pensant bien faire.
Comment bien faire
Dans un premier temps on va renouveler l’eau de transport avec une eau a un pH équivalent. Pour ce faire on va utiliser du CO2 et faire baisser le pH d’une eau nouvellement préparée. Une fois l’eau renouvelée on va pouvoir commencer a doucement remonter le pH en utilisant un bulleur.
Une fois le pH a un niveau normal on peut acclimater les animaux a la chimie de l’eau de l’aquarium si besoin.
Les références
Proton exchange between ammonium ion, trimethyl-ammonium ion, and water. Speed of the dehydration step that precedes bimolecular proton transfer. Grunwald, Ernest; Ku, Alice Y. Brandeis Univ., Waltham, MA, USA. Journal of the American Chemical Society (1968), 90(1), 29-31.
A chemical model of seawater including dissolved ammonia and the stoichiometric dissociation constant of ammonia in estuarine water and seawater from -2 to 40° C. Clegg, Simon L.; Whitfield, Michael. Sch. Environ. Sci., Univ. East Anglia, Norwich, UK. Geochimica et Cosmochimica Acta (1995), 59(12), 2403-21.
Measurement of Diffusive Flux of Ammonia from Water. Zhang, Genfa; Uehara, Tomoe; Dasgupta, Purnendu K.; Clarke, Antony D.; Winiwarter, Wilfried. Department of Chemistry and Biochemistry, Texas Tech University, Lubbock, TX, USA. Analytical Chemistry (1998), 70(17), 3656-3666.
Ammonia excretion and urea handling by fish gills: present understanding and future research challenges. Wilkie, Michael Patrick. Division of Life Sciences, University of Toronto at Scarborough, Scarborough, ON, Can. Journal of Experimental Zoology (2002), 293(3), 284-301.
Chemical Oceanography, Second Edition. Millero, Frank J.; Editor. USA. (1996), 496 pp.
Captive seawater fishes: Science and technology. Spotte, Stephen; John Wiley & Sons, New York, 1992 ISBN 0-471-54554-6.
Seawater Aquariums: The Captive Environment. Spotte, Stephen; John Wiley & Sons, NY 1972 ISBN 0471056650.
16S rRNA and amoA-based phylogeny of 12 novel betaproteobacterial ammonia-oxidizing isolates: extension of the dataset and proposal of a new lineage within the nitrosomonads. Purkhold, Ulrike; Wagner, Michael; Timmermann, Gabriele; Pommerening-Roeser, Andreas; Koops, Hans-Peter. Lehrstuhl fuer Mikrobiologie, Technische Universitaet Muenchen, Freising, Germany. International Journal of Systematic and Evolutionary Microbiology (2003), 53(5), 1485-1494.
Biogeochemical processes in a small California estuary. 2. Nitrification activity, community structure and role in nitrogen budgets. Caffrey, Jane M.; Harrington, Neil; Solem, Icarus; Ward, Bess B. Center for Environmental Diagnostics and Bioremediation, University of West Florida, Pensacola, FL, USA. Marine Ecology: Progress Series (2003), 248 27-40.
Worldwide distribution of Nitrosococcus oceani, a marine ammonia-oxidizing -proteobacterium, detected by PCR and sequencing of 16S rRNA and amoA genes. Ward, Bess B.; O’Mullan, Gregory D. Department of Geosciences, Princeton University, Princeton, NJ, USA. Applied and Environmental Microbiology (2002), 68(8), 4153-4157.
Elevated salinity selects for a less diverse ammonia-oxidizing population in aquarium biofilters. Grommen, Roeland; Dauw, Lenny; Verstraete, Willy. Laboratory of Microbial Ecology and Technology (LabMET), Ghent, Belg. FEMS Microbiology Ecology (2005), 52(1), 1-11.
Comparative analysis of nitrifying bacteria associated with freshwater and marine aquaria. Hovanec, Timothy A.; DeLong, Edward F. Ecology, Evolution Marine Biol. Dep., Univ. California, Santa Barbara, CA, USA. Applied and Environmental Microbiology (1996), 62(8), 2888-2896.
Nitrogen-versus phosphorus-limited growth and sources of nutrients for coral reef macroalgae. Larned, S.T. Marine Biology (1998) 132: 409±421.
Ammonia in estuaries and effects on fish. Eddy, F.B. Environmental and Applied Biology, University of Dundee, Dundee, UK. Journal of Fish Biology (2005), 67(6), 1495-1513.
Low levels of environmental ammonia increase susceptibility to disease in Chinook salmon smolts. Ackerman, Paige A.; Wicks, Beverly J.; Iwama, George K.; Randall, David J. Faculty of Land and Food Systems, University of British Columbia, Vancouver, BC, Can. Physiological and Biochemical Zoology (2006), 79(4), 695-707.
Mechanism of the reaction of ammonia with the bisulfite derivative of formaldehyde. Henaff, Philippe Le. Compt. Rend. (1963), 256 3090-2.
Method and Product for removal of chloramines, chlorine, and ammonia from aquaculture water. Kuhns, John F. US Patent #4,666,610; May 19, 1987.
Ammonia and the reef aquarium. reefkeeping Magazine 2007






















